Pfizer și BioNTech cer Agenţiei americane a medicamentului FDA autorizarea de urgenţă a vaccinului COVID-19. Primele vaccinări ar putea avea loc până la sfârşitul anului

Pfizer, vaccin
Pfizer a anunţat vineri că a depus o cerere, la Agenţia americană a medicamentului (Food and Drug Administration, FDA), în vederea unei autorizări de urgenţă a punerii pe piaţă în Statele Unite a vaccinului candidat împotriva COVID-19 pe care l-a dezvoltat împreună cu compania germană BioNTech.
Alianţa Pfizer/BioNTech a anunţat miercuri că acest vaccin este eficient 95% şi că nu are efecte secundare importante.
Anunţul de vineri a fost ”salutat” de pieţele financiare, unde acţiunile Pfizer au crescut cu 2%, iar ale BioNTech cu 5% în tranzacţii prebursiere, scrie News.ro.
Pfizer se aşteaptă ca FDA să-i acorde această EUA până la mijlocul lui decembrie şi să înceapă după aceea să facă primele livrări.
În total 50 de milioane de doze urmează să fie disponibile începând în 2020 - pentru vaccinarea a 25 de milioane de persoane.
Un comitet consultativ FDA urmează să se reunească în perioada 8-10 decembrie, pentru a discuta despre vaccinul Pfizer/BioNTech, a declarat pentru Reuters o sursă, care precizează că această agendă ar putea fi modificată.
Secretarul american al Sănătăţii şi Serviciilor Sociale Alex Azar declara miercuri că Pfizer, la fel ca rivala sa Moderna, ar putea să obţină autorizaţiile de la autoritatea de reglementare în următoarele săptămâni şi că primele vaccinări pot avea loc până la sfârşitul anului.
Joi seara, preşedinta Comisiei Europene, Ursula von der Leyen, a declarat că Uniunea Europeană ar putea da undă verde la mijlocul lui decembrie vaccinurilor dezvoltate de companiile Moderna şi Pfizer/BioNTech.
Agenţia Europeană a Medicamentului (EMA) se află ”în discuţii zilnice” cu instituţia americană omoloagă, FDA, pentru ”sincronizarea evaluărilor lor asupra vaccinurilor” anti-COVID-19, a anunțat Ursula von der Leyen.
Pe acelasi subiect:
 VOYO
VOYO

 RON
RON RON
RON RON
RON RON
RON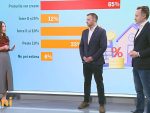 (P) iBani. Piața imobiliară după majorarea TVA. Sfaturi pentru cei interesați să cumpere o locuință nouă
(P) iBani. Piața imobiliară după majorarea TVA. Sfaturi pentru cei interesați să cumpere o locuință nouă
 ”Incont”, site-ul Știrile Pro TV de informații economice și educație financiară, a devenit ”iBani”
”Incont”, site-ul Știrile Pro TV de informații economice și educație financiară, a devenit ”iBani”  România, departe de zona euro. Analist: Probabil ne ducem spre 2030 cu adoptarea monedei unice
România, departe de zona euro. Analist: Probabil ne ducem spre 2030 cu adoptarea monedei unice
 Popa, CFA România: Într-o lume fără pensii private ar trebui să ne aşteptăm la o pensie de 32% din ultimul salariu
Popa, CFA România: Într-o lume fără pensii private ar trebui să ne aşteptăm la o pensie de 32% din ultimul salariu
 Siemens Energy anunţă concedieri masive pentru a-şi majora profitul. Compania are mii de angajați în România
Siemens Energy anunţă concedieri masive pentru a-şi majora profitul. Compania are mii de angajați în România
 Cu trenul de la Paris la Viena sau de la Zurich la Barcelona. Pandemia reînvie cursele feroviare de noapte în Europa
Cu trenul de la Paris la Viena sau de la Zurich la Barcelona. Pandemia reînvie cursele feroviare de noapte în Europa  (P) De ce aleg românii să joace la pariuri
(P) De ce aleg românii să joace la pariuri
 (P) Tot ce trebuie să știi despre vigneta Ungaria și prețul acesteia
(P) Tot ce trebuie să știi despre vigneta Ungaria și prețul acesteia
 Digitalizarea departamentului HR - un subiect în trend chiar și pentru companiile de IT
Digitalizarea departamentului HR - un subiect în trend chiar și pentru companiile de IT
 Huawei dezminte zvonurile privind vânzarea brandurilor premium de smartphone P şi Mate
Huawei dezminte zvonurile privind vânzarea brandurilor premium de smartphone P şi Mate  Cum vom lucra în 2021: 60% dintre companii vor să reînceapă munca de la birou din luna martie. Mai mult de jumătate au tăiat programele de training şi pe cele de wellbeing
Cum vom lucra în 2021: 60% dintre companii vor să reînceapă munca de la birou din luna martie. Mai mult de jumătate au tăiat programele de training şi pe cele de wellbeing  Două treimi din forţa de muncă existentă la nivel global lucrează de acasă, însă unul din trei angajaţi folosește propriul calculator pentru a-şi desfăşura activitatea
Două treimi din forţa de muncă existentă la nivel global lucrează de acasă, însă unul din trei angajaţi folosește propriul calculator pentru a-şi desfăşura activitatea 
 Invață să ții sub control cheltuielile de sărbători. Cum funcționează cardul de cumpărături
Invață să ții sub control cheltuielile de sărbători. Cum funcționează cardul de cumpărături  Moneda euro la 20 de ani. Cea mai importantă realizare macro-economică a secolului trecut a supraviețuit marii crize mondiale, dar rămâne un colos handicapat de propriile slăbiciuni
Moneda euro la 20 de ani. Cea mai importantă realizare macro-economică a secolului trecut a supraviețuit marii crize mondiale, dar rămâne un colos handicapat de propriile slăbiciuni
 UE pregătește măsuri de urgență, în cazul unui ”no deal” cu Londra, din ianuarie. Domeniile vizate: pescuitul şi transportul rutier şi aerian
UE pregătește măsuri de urgență, în cazul unui ”no deal” cu Londra, din ianuarie. Domeniile vizate: pescuitul şi transportul rutier şi aerian
 Explozie la gazoductul din Ucraina care asigura gazele pentru Europa. Ce se întâmplă cu livrările de gaze rusești spre continent
Explozie la gazoductul din Ucraina care asigura gazele pentru Europa. Ce se întâmplă cu livrările de gaze rusești spre continent




 RSS
RSS