Biogen este pe cale să obţină autorizarea unui medicament pentru Alzheimer. Acţiunile companiei farma au urcat cu 40%
Medicamente
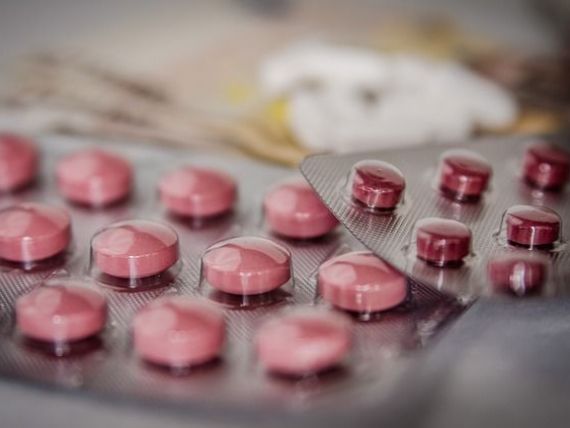
Compania farmaceutică Biogen a prezentat ”dovezi extraordinar de convingătoare” că medicamentul său experimental pentru Alzheimer este eficace, potrivit unei comisii de experţi ai Administraţiei pentru Alimente şi Medicamente (FDA) din SUA.
Informaţia măreşte şansele unei aprobări rapide a tratamentului de către instituţia americană.
Aprobarea oficială din partea FDA ar putea avea loc până în luna martie, ceea ce ar face ca medicamentul aducanumab să devină primul tratament nou pentru Alzheimer din ultimele decenii şi primul care pare să încetinească progresia bolii mintale care afectează milioane de oameni.
Acţiunile Biogen şi ale partenerei sale Eisai au crescut fiecare cu 40%, scrie News.ro.
Comentariile experţilor FDA au dus şi la creşterea acţiunilor altor dezvoltatori de medicamente pentru Alzheimer. Titlurile Eli Lilly au urcat cu 15%.
FDA a publicat documentele înaintea unei întâlniri de vineri a unor experţi externi, care vor evalua şi vor decide dacă vor recomanda aprobarea aducanumab, un medicament cu anticorpi menit să elimine plăcile amiloide din creier.
”Documentele sugerează un vot pozitiv al Comisiei Consultative”, a afirmat Yatin Suneja, analist la Guggenheim, într-o notă adresată clienţilor.
Un analist al Mizuho Securities, Salim Syed, a spus că este vorba ”de scenariul cel mai favorabil” pentru Biogen.
Reprezentanţii FDA care au evaluat medicamentul aducanumab au spus că rezultatele unui studiu clinic important pentru aducanumab sunt convingătoare şi extrem de favorabile. Aceştia au recunoscut că un al doilea studiu clinic pe scară largă nu a reuşit, dar au susţinut că acesta nu reducere meritele primului studiu clinic.
FDA nu este obligată să respecte recomandările comisiei de experţi, dar de obicei o face.
Un evaluator statistic al FDA a spus că este necesar un nou studiu pentru a confirma dacă aducanumab este eficace.
”Nu există dovezi substanţiale convingătoare ale eficacităţii tratamentului sau de încetinire a bolii”, a scris Tristan Massie, un angajat al FDA, în evaluarea sa.
Boala Alzheimer afectează aproape 6 milioane de americani şi alte milioane de oameni la nivel mondial. Biogen estimează că aproximativ 1,5 milioane de oameni cu forme incipiente de Alzheimer din Statele Unite ar putea fi candidaţi pentru medicamentul său.
Grupurile pentru protecţia pacienţilor au afirmat că este nevoie ca aducanumab să fie aprobat din cauza nevoii nesatisfăcute pentru un medicament de acest tip.
”Dacă va fi recomandat un al treilea studiu clinic, ar putea trece ani...în timp ce oamenii nu vor avea acces la medicament”, a spus dr. Howard Fillit, director ştiinţific la Alzheimer’s Drug Discovery Foundation.
Biogen şi investitorii săi au nevoie de aprobarea aducanumab după ce compania a pierdut recent un litigiu referitor la un brevet pentru medicamentul său pentru tratarea sclerozei multiple Tecfidera.
Dacă aducanumab va fi aprobat, acesta ar putea genera vânzări anuale de 5,3 miliarde de dolari până în 2025, potrivit datelor Refinitiv.
Pe acelasi subiect:
 VOYO
VOYO

 RON
RON RON
RON RON
RON RON
RON (P) iBani. Piața imobiliară după majorarea TVA. Sfaturi pentru cei interesați să cumpere o locuință nouă
(P) iBani. Piața imobiliară după majorarea TVA. Sfaturi pentru cei interesați să cumpere o locuință nouă
 ”Incont”, site-ul Știrile Pro TV de informații economice și educație financiară, a devenit ”iBani”
”Incont”, site-ul Știrile Pro TV de informații economice și educație financiară, a devenit ”iBani”  România, departe de zona euro. Analist: Probabil ne ducem spre 2030 cu adoptarea monedei unice
România, departe de zona euro. Analist: Probabil ne ducem spre 2030 cu adoptarea monedei unice
 Popa, CFA România: Într-o lume fără pensii private ar trebui să ne aşteptăm la o pensie de 32% din ultimul salariu
Popa, CFA România: Într-o lume fără pensii private ar trebui să ne aşteptăm la o pensie de 32% din ultimul salariu
 Siemens Energy anunţă concedieri masive pentru a-şi majora profitul. Compania are mii de angajați în România
Siemens Energy anunţă concedieri masive pentru a-şi majora profitul. Compania are mii de angajați în România
 Cu trenul de la Paris la Viena sau de la Zurich la Barcelona. Pandemia reînvie cursele feroviare de noapte în Europa
Cu trenul de la Paris la Viena sau de la Zurich la Barcelona. Pandemia reînvie cursele feroviare de noapte în Europa  (P) De ce aleg românii să joace la pariuri
(P) De ce aleg românii să joace la pariuri
 (P) Tot ce trebuie să știi despre vigneta Ungaria și prețul acesteia
(P) Tot ce trebuie să știi despre vigneta Ungaria și prețul acesteia
 Digitalizarea departamentului HR - un subiect în trend chiar și pentru companiile de IT
Digitalizarea departamentului HR - un subiect în trend chiar și pentru companiile de IT
 Huawei dezminte zvonurile privind vânzarea brandurilor premium de smartphone P şi Mate
Huawei dezminte zvonurile privind vânzarea brandurilor premium de smartphone P şi Mate  Cum vom lucra în 2021: 60% dintre companii vor să reînceapă munca de la birou din luna martie. Mai mult de jumătate au tăiat programele de training şi pe cele de wellbeing
Cum vom lucra în 2021: 60% dintre companii vor să reînceapă munca de la birou din luna martie. Mai mult de jumătate au tăiat programele de training şi pe cele de wellbeing  Două treimi din forţa de muncă existentă la nivel global lucrează de acasă, însă unul din trei angajaţi folosește propriul calculator pentru a-şi desfăşura activitatea
Două treimi din forţa de muncă existentă la nivel global lucrează de acasă, însă unul din trei angajaţi folosește propriul calculator pentru a-şi desfăşura activitatea 
 Invață să ții sub control cheltuielile de sărbători. Cum funcționează cardul de cumpărături
Invață să ții sub control cheltuielile de sărbători. Cum funcționează cardul de cumpărături  Moneda euro la 20 de ani. Cea mai importantă realizare macro-economică a secolului trecut a supraviețuit marii crize mondiale, dar rămâne un colos handicapat de propriile slăbiciuni
Moneda euro la 20 de ani. Cea mai importantă realizare macro-economică a secolului trecut a supraviețuit marii crize mondiale, dar rămâne un colos handicapat de propriile slăbiciuni
 UE pregătește măsuri de urgență, în cazul unui ”no deal” cu Londra, din ianuarie. Domeniile vizate: pescuitul şi transportul rutier şi aerian
UE pregătește măsuri de urgență, în cazul unui ”no deal” cu Londra, din ianuarie. Domeniile vizate: pescuitul şi transportul rutier şi aerian
 Explozie la gazoductul din Ucraina care asigura gazele pentru Europa. Ce se întâmplă cu livrările de gaze rusești spre continent
Explozie la gazoductul din Ucraina care asigura gazele pentru Europa. Ce se întâmplă cu livrările de gaze rusești spre continent




 RSS
RSS